 Вирус герпеса 4 типа – вирус Эпштейна-Барр (ВЭБ) один из самых распространенных на Земле. В чем его опасность и будет ли найдена эффективная вакцина, рассказывает врач-вирусолог, заведующая отделом вирусологии НМИЦ гематологии Минздрава России, доктор медицинских наук Татьяна Туполева.
Вирус герпеса 4 типа – вирус Эпштейна-Барр (ВЭБ) один из самых распространенных на Земле. В чем его опасность и будет ли найдена эффективная вакцина, рассказывает врач-вирусолог, заведующая отделом вирусологии НМИЦ гематологии Минздрава России, доктор медицинских наук Татьяна Туполева.
— Что представляет собой вирус Эпштейна-Барр?
Вирус Эпштейна-Барр относится к семейству герпесвирусов. В отличие от большинства других вирусов, он не уничтожает клетку-хозяина, а, напротив, ускоряет ее деление и продолжает существовать во всех дочерних клетках. Вирионы ВЭБ способны делиться и в опухолевых клетках. Вирус Эпштейна-Барр является фактором риска рассеянного склероза и некоторых злокачественных опухолей: лимфомы Ходжкина, лимфомы Бёркитта, рака носоглотки, рака желудка.
— Правда ли, что вирус Эпштейна-Барр — самый распространенный вирус на Земле?
95% жителей Земли являются носителями вируса Эпштейна-Барр. Инфицирование происходит в первые годы жизни и, как правило, не дает никаких симптомов. Казалось бы, может ли быть опасен вирус, который есть почти у каждого? Оказывается, да. Ежегодно в мире регистрируется порядка 200 000 новых случаев ВЭБ-ассоциированных злокачественных новообразований. Кроме того, ВЭБ является причиной инфекционного мононуклеоза.
 ВЭБ особенно опасен для пациентов с иммунодефицитом, которых особенно много среди пациентов гематологических киник, поскольку терапия онкологических заболеваний крови приводит к глубокому угнетению гуморального и клеточного иммунитета. Кроме того, у этой категории пациентов высок риск развития инфекционных осложнений, в том числе связанных с ВЭБ.
ВЭБ особенно опасен для пациентов с иммунодефицитом, которых особенно много среди пациентов гематологических киник, поскольку терапия онкологических заболеваний крови приводит к глубокому угнетению гуморального и клеточного иммунитета. Кроме того, у этой категории пациентов высок риск развития инфекционных осложнений, в том числе связанных с ВЭБ.
В настоящее время нет эффективной этиотропной терапии ВЭБ-инфекции. Единственным вариантом защиты от вируса может стать вакцина.
— Существуют ли вакцины против вируса Эпштейна-Барр?
Разработка эффективной и безопасной вакцины против вируса Эпштейна-Барр является важной задачей и ведется уже около 30 лет. Еще в 1992 году английские ученые S. Finerty с соавт. опубликовали работу*, в которой было продемонстрировано, что вакцина, содержащая в качестве действующего агента гликопротеин gp340 оболочки вируса и квасцы в качестве адьюванта, стимулировала иммунную реакцию у трех из пяти лабораторных животных против ВЭБ-индуцированной лимфомы. На встрече, состоявшейся в штате Мэриленд в феврале 2011 года, участники пришли к выводу о необходимости разработки вакцин против ВЭБ для предотвращения как инфекционного мононуклеоза, так и ВЭБ-ассоциированных злокачественных новообразований.
Гликопротеин gp350 обладает сильным иммуностимулирующим действием, чаще всего именно против него направлены вируснейтрализующие антитела. Поэтому он является основной мишенью при создании профилактической вакцины. В работе, посвященной II фазе исследования gp350-анти-ВЭБ вакцины**, сообщалось о снижении частоты инфекционного мононуклеоза в результате применения этой вакцины. Однако вакцина не оказывала влияния на частоту инфицирования вирусом.
Компания Moderna и Национальный институт здравоохранения США проводят клинические исследования I фазы изучения безопасности и иммуногенности двух различных вакцин против ВЭБ***: одна вакцина создана на основе вирусной мРНК, а другая – на основе наночастиц.
Вместе с тем, на сегодняшний день нет лицензированных вакцин против ВЭБ для предотвращения первичной инфекции или развития ВЭБ-ассоциированных заболеваний, а также терапевтических вакцин для лечения злокачественных новообразований, поскольку ни одна из кандидатных вакцин на настоящий момент не прошла все фазы клинических испытаний.
— В августе 2023 года в журнале Nature Communications было опубликовано исследование австралийских и американских ученых, посвященное новой вакцине против ВЭБ. Расскажите, пожалуйста, в чем суть этого исследования?
Новая вакцина против ВЭБ содержит 20 потенциальных Т-клеточных мишеней, и в этом ее главное отличие от более ранних разработок. Кроме того, в состав вакцины входит полноразмерный вирусный гликопротеин gp350, участвующий в проникновении вируса в В-клетки, а также амфифильный адъювант — вещество, усиливающее иммунный ответ.
Авторы статьи создали структуру, напоминающую «бусины на нитке», из 20 отдельных высококонсервативных CD8+ Т-клеточных эпитопов, которые разделены между собой сайтами для протеолитического расщепления. К концу каждого эпитопа пришита высококонсервативная пептидная последовательность, повышающая иммуногенность всей конструкции.
— Как вы оцениваете эффективность и перспективы новой вакцины?
Новая вакцина изучалась на модельных мышах. Была показана её способность эффективно подавлять прогрессию ВЭБ-ассоциированной лимфомы in vivo и её высокая иммуногенность. Продемонстрировано длительное сохранение противовирусного иммунитета, вызванного этой вакциной. Но до широкого использования данной вакцины с целью профилактики первичного инфицирования ВЭБ и лечения ВЭБ-индуцированных заболеваний у людей еще далеко.
— Кому и с какой целью может быть показано применение анти-ВЭБ вакцин?
Иммунизация с помощью подобных вакцин детей может помочь предотвратить первичное инфицирование ВЭБ, которое, как правило, происходит в первые годы жизни. Оправдано также применение терапевтических анти-ВЭБ вакцин у пациентов для лечения ВЭБ-ассоциированных заболеваний.
— Как вы думаете, почему разработка вакцины против вируса Эпштейна-Барр оказалась такой сложной задачей, и когда, по вашей оценке, такая вакцина может появиться?
Разработка любой противовирусной вакцины является сложной задачей, особенно в случае вирусов с высокой изменчивостью (например, вирус гепатита С и ВИЧ) или особенностью жизненного цикла. Последнее утверждение справедливо в отношении вируса Эпштейна-Барр. Во-первых, он поражает два разных типа ткани – эпителиальную и лимфоидную. Во-вторых, может существовать в организме в различных формах – активной инфекции и латентном виде, когда синтезируются не все вирусные белки, а только их малая часть. Также вирус способен частично встраивать свой геном в клеточную ДНК, после чего удалить его оттуда не представляется возможным****. Поэтому говорить о сроках появления эффективной и безопасной вакцины против ВЭБ сложно.
*Finerty S., Tarlton J. Macket M., et al. Protective immunization again Epstein-Barr virus-induced disease in cottontop tamarius using the virus envelope glycoproteine gp340 produced from a bovin papillomavirus expression vector. J. Gen. Virol. 1992; 73: 449–53 https://pubmed.ncbi.nlm.nih.gov/1311367/
** Sokal E.M., Hoppenbrouwers K., Vandermeulen C., Moutschen M., Léonard Ph., Moreels A., Haumont M., Bollen A., Smets F., Denis M. Recombinant gp350 vaccine for infectious mononucleosis: a phase 2, randomized, double-blind, placebo-controlled trial to evaluate the safety, immunogenicity, and effi cacy of an Epstein-Barr virus vaccine in healthy young adults. J. Infect. Dis. 2007; 196 (12): 1749–53. DOI: https://doi.org/ 10.1086/523813 https://pubmed.ncbi.nlm.nih.gov/18190254/
*** Rozman M. et al. Progress in prophylactic and therapeutic EBV vaccine development based on molecular characteristics of EBV target antigens //Pathogens. – 2022. – Т. 11. – №. 8. – С. 864.; Wei C. J. et al. A bivalent Epstein-Barr virus vaccine induces neutralizing antibodies that block infection and confer immunity in humanized mice //Science translational medicine. – 2022. – Т. 14. – №. 643. – С. eabf3685 https://pubmed.ncbi.nlm.nih.gov/36014985/
**** Liang J. et al. DeepEBV: a deep learning model to predict Epstein–Barr virus (EBV) integration sites //Bioinformatics. – 2021. – Т. 37. – №. 20. – С. 3405-3411 https://pubmed.ncbi.nlm.nih.gov/34009299/
На фото:
1. Татьяна Туполева, врач-вирусолог, заведующая отделом вирусологии НМИЦ гематологии Минздрава России, доктор медицинских наук
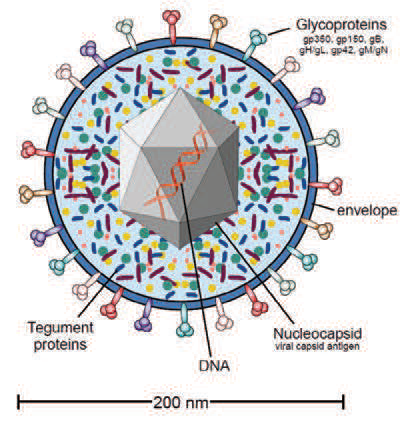
2. Cхема вириона вируса Эпштейна-Барр.//Fields Virology, 2 Volumes Set, 6th Edition, Jun 17, 2013, David M. Knipe, Peter Howley, LWW, ISBN: 9781451105636, Hardbound. Pages: 2664.
3. Работа в лаборатории вирусологии НМИЦ гематологии Минздрава России



